
题目列表(包括答案和解析)
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g) + 2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
右图是反应I反应过程中的能量变化曲线。
(1)由右图可知反应I为 反应(选填”吸热、放热”),反应热△H1=
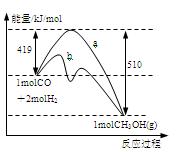
(2)反应I在一定体积的密闭容器中进行,能判断其是否达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(CH3OH) D.c(CO)=c(CH3OH)
(3)图中曲线 表示使用催化剂时反应的能量变化。
(4)一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数数
K值= (用分数表示),若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡时CH3OH的转化率为 ,若平衡后在充入4 mol的N2,则C(CO2)是 。
(5)从绿色化学的角度比较上述两种方法,符合原子经济的是 。(填“I” 或“II”)
(16分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) CH3OH(g) ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH = -1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为 ,(3分)随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为 一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(3分)(标况下)。
(14分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) CH3OH(g) ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。

①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g)+ 4H2O(l) ΔH = -1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,则负极的电极反应式为 ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为 ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
反应II: CO2(g)+ 3H2(g) CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0(填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6mol H2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的该反应的反应速率为: ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为 。
② 用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为 (溶液体积变化忽略不计),要使电解后溶液复原,所加物质为 (填名称)。
(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
(1)工业上一般采用下列两种反应合成甲醇
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
上述反应符合“原子经济”原则的是: (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g)+ 4H2O(g) ΔH =-1275.6 kJ·mol-1
② 2CO (g)+ O2(g)= 2CO2(g) ΔH =-566.0 kJ·mol-1
③ H2O(g) = H2O(l) ΔH = -44.0kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
__________________________________________________
(3)甲醇—空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇—空气燃料电池放电时正极的电极反应式。
。
(4)下图是一个电化学过程示意图。
① 锌片上发生的电极反应式为 。
② 假设使用甲醇—空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要 mol甲醇。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com