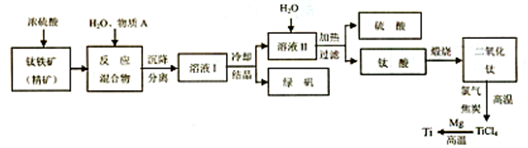
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料.
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe
2O
3的钛铁矿(主要成分为FeTiO
3,其中Ti元素化合价为+4价)制取,其主要流程如下:
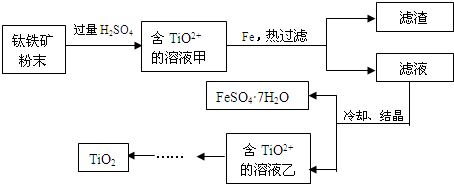
(1)Fe
2O
3与H
2SO
4反应的离子方程式是
Fe2O3+6H+=2Fe3++3H2O
Fe2O3+6H+=2Fe3++3H2O
.
(2)甲溶液中除含TiO
2+之外还含有的金属阳离子有
Fe3+、Fe2+
Fe3+、Fe2+
.
(3)加Fe的作用是
将Fe3+转化为Fe2+
将Fe3+转化为Fe2+
.
方法2:TiCl
4水解生成TiO
2?xH
2O,过滤、水洗除去其中的Cl
-,再烘干、焙烧除去水分得到粉体TiO
2,此方法制备得到的是纳米二氧化钛.
(4)①TiCl
4水解生成TiO
2?xH
2O的化学方程式为
TiCl4+(x+2)H2O?TiO2?xH2O↓+4HCl
TiCl4+(x+2)H2O?TiO2?xH2O↓+4HCl
;
②检验TiO
2?xH
2O中Cl
-是否被除净的方法是
取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净
取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净
.
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO
2制取单质Ti,涉及到的步骤如下:TiO2
TiCl
4Ti
反应②的方程式是
,该反应需要在Ar气氛中进行,请解释原因:
防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
.