
题目列表(包括答案和解析)
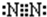
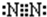
(13分)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与![]() 分子互为等电子体的微粒 (填1种)。
分子互为等电子体的微粒 (填1种)。
(2)水分子在特定条件下容易得到一个![]() ,形成水合氢离子(
,形成水合氢离子(![]() )。下列对上述过程的描述不合理的是 。
)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)![]() 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。
(5) 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:
_______________________________;_______________________________。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
(6)实验过程中加入![]() 后可观察到析出深蓝色
后可观察到析出深蓝色![]() 晶体。实验中所加
晶体。实验中所加![]() 的作用是__________________________________________________
的作用是__________________________________________________
(13分)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入 极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1) 写出与
写出与 分子互为等电子体的微粒 (填1种)。
分子互为等电子体的微粒 (填1种)。
(2)水分子在特定条件下容易得到一个 ,形成水合氢离子(
,形成水合氢离子( )。下列对上述过程的描述不
)。下列对上述过程的描述不 合理的是 。
合理的是 。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________ 后可观察到析出深蓝色
后可观察到析出深蓝色 晶体。实验中所加
晶体。实验中所加 的作用是__________________________________________________
的作用是__________________________________________________回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)已知:波长为300nm的紫外光的光子所具有的
能量约为39 9 kJ/mol。
根据右表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:______________________________________________________________
_____________________________________________________________。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示: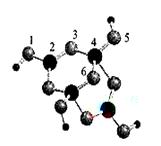
 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。 、
、 和
和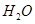 构成,它们之间存在的作用力有 (填序号)。
构成,它们之间存在的作用力有 (填序号)。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com