
题目列表(包括答案和解析)
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu-
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
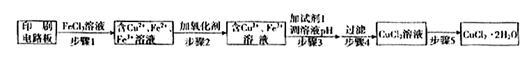
①证明步骤I所加FeCl3溶液过量的方法是 。
②步骤2中所加的氧化剂最适宜的是 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)=====CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)====2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+![]() O2(g)====H2O(l) △H3=-286kJ/mol
O2(g)====H2O(l) △H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)====CuSO4(aq)+H2(g)的△H= 。
(3)欲实现反应Cu+H2SO2====CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)

(14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O22Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu-
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:

①证明步骤I所加FeCl3溶液过量的方法是 。
②步骤2中所加的氧化剂最适宜的是 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)=====CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)====2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+![]() O2(g)====H2O(l) △H3=-286kJ/mol
O2(g)====H2O(l) △H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)====CuSO4(aq)+H2(g)的△H= 。
(3)欲实现反应Cu+H2SO2====CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)

(14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: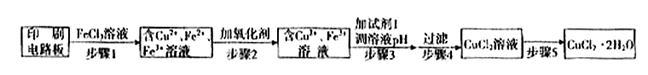 ①证明步骤I所加FeCl3溶液过量的方法是 。
①证明步骤I所加FeCl3溶液过量的方法是 。
②步骤2中所加的氧化剂最适宜的是 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)===CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)==2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+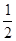 O2(g)==H2O(l) △H3=-286kJ/mol
O2(g)==H2O(l) △H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)的△H= 。
(3)欲实现反应Cu+H2SO2==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)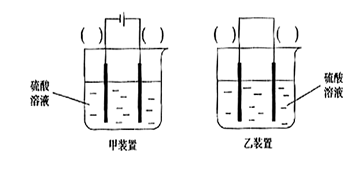
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__________ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:

①步骤1中反应的离子方程式是_______________。
②步骤2所加的氧化剂最适宜的是____________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为__________
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是__________(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
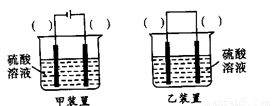
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式。
铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S +
O2 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
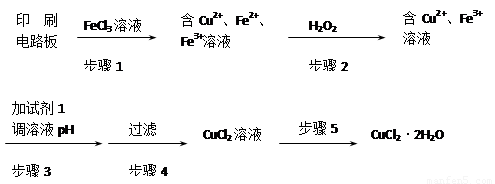
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com