
题目列表(包括答案和解析)
在一定质量的氯化钡溶液中,逐滴加入密度为![]() 的硫酸溶液,当加入的
的硫酸溶液,当加入的![]() 与
与![]() 恰好完全反应时,所得溶液的质量与原氯化钡溶液的质量相等,计算该硫酸溶液的物质的量浓度.
恰好完全反应时,所得溶液的质量与原氯化钡溶液的质量相等,计算该硫酸溶液的物质的量浓度.
在VmLBaCl2溶液中加入一定体积0.0500mol·L-1 H2SO4溶液时,两者恰好完全反应.此时溶液的pH=3.0.求:
(1)加入硫酸溶液的体积(用含V的表达式表示,设溶液混合时体积变化忽略不计);
(2)氯化钡溶液的物质的量浓度.
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是______________、氯碱工业的装置是_____________________。
(2)写出生产过程中X__________? Y___________ (填化学式)
(3)写出产生CuCl的化学方程式________________________________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是______________________________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是__________________________。
(6)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
_____________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2????? Fe2+ + Ce4+ = Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
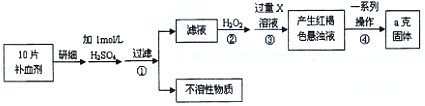
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)将样品研细的目的是:
(2)步骤②加入过量H2O2的目的是:
能证明该反应已进行完全的试剂是 K^S*5U.C#O%
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性![]() 溶液
溶液
(3)步骤③中若X为氨水,则反应的离子方程式为:
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、冷却、称量。
(5)若实验无损耗,则该样品中含铁元素的质量 g(用含a的代数式表示,不用化简)。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定,反应原理如下:
□Fe2+ + □MnO4— + □ →□Fe3+ +□Mn2+ +□H2O
试完成并配平上述离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com