
题目列表(包括答案和解析)
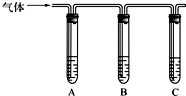 (2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.
(2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 ③ ③ (填序号);试管B中加1%品红溶液; 试管C中加 ⑤ ⑤ (填序号). |
若 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 ,则甲成立. |
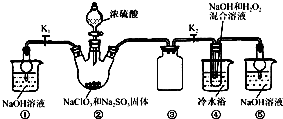
av1-
| ||
| 25 |
av1-
| ||
| 25 |
| O | - 2 |
| O | - 2 |
| O | 2- 6 |
| 90.5cV |
| 4m |
| 90.5cV |
| 4m |
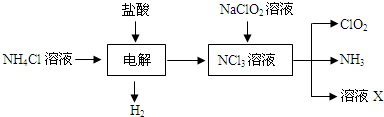
| 实验步骤 | 实验现象 | 实验结论 |
| ① 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 |
火焰呈黄色 火焰呈黄色 |
溶液X中含有钠离子 |
| ② 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) |
产生白色沉淀 产生白色沉淀 |
溶液X中含有氯离子 |
| ||
| ||
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计算) | 20~50mg/kg |
| 分装日期 | \ |
| 分装企业 | \ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com