
题目列表(包括答案和解析)



| ||
| ||
A.钡单质可以从NaCl溶液中置换出金属钠
B.单质钡可以从冷水中置换氢得到氢气
C.BaO2可与水反应放出O2
D.钡元素在自然界中主要以难溶盐形式存在
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.铈(Ce)元素在自然界中主要以单质形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+
D.四种稳定的核素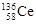 、
、 、
、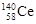 、
、 ,它们互称为同位素
,它们互称为同位素
已知金属钡的金属活动性处于钾和钠之间。下列说法中不正确的是( )
A.钡单质可以从NaCl溶液中置换出金属钠
B.单质钡可以从冷水中置换氢得到氢气
C.BaO2可与水反应放出O2
D.钡元素在自然界中主要以难溶盐形式存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com