
题目列表(包括答案和解析)
将充有m mLNO和n mLNO2气体的试管倒立于水槽中,然后通入m mLO2,若已知n>m,
则充分反应后,试管中的气体在同温同压下的体积为( )
A.(4n-1)/12
B.(n-m)/3
C.(3m+n)/3
D.3(n-m)
则充分反应后,试管中的气体在同温同压下的体积为( )
A.(4n-1)/12
B.(n-m)/3
C.(3m+n)/3
D.3(n-m)
A.b+n+3 B.b+n-3
C.b-n+3 D.b-n-3
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
|
温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H 0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将 ,正反应速率 (填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。
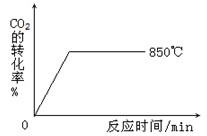
(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
|
|
A |
B |
C |
D |
E |
|
n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是: ▲ 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 ▲ (选填A、B、C、D、E)。
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(3)已知在一定温度下:C(s)+CO2(g) ![]() 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) ![]() CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)![]() H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: ▲ 。
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为: ▲ 。
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= ▲ 。
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com