
题目列表(包括答案和解析)
当一个可逆反应达到平衡状态后,如果改变________、________、________等反应的条件,原来的________会被破坏,化学平衡会发生移动,建立新的化学平衡.
(1)此时混合气体的平均相对分子质量为________,CO的转化率为________。
(2)保持温度、体积不变,再向容器中通入0.02 mol H2O(g),建立新平衡,c(H2)平衡=________,混合气体的平均相对分子质量为________,CO的转化率为________。
(3)其他条件不变,当温度升高时,CO的转化率________;当容器被压缩至0.5 L时,H2的体积分数相对原平衡________ (填“升高”“降低”或“不变”)。
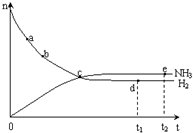 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 4NO2(g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
 2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)
2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com