
题目列表(包括答案和解析)
NA表示阿伏加德罗常数,下列说法中正确的是
| A.H2SO4的摩尔质量是98 |
| B.1.7g NH3含有的电子数为NA |
| C.摩尔、质量、时间、长度等是7个基本物理量之一 |
| D.22.4L氧气含有的分子数为NA |
| A.H2SO4的摩尔质量是98 |
| B.1.7g NH3含有的电子数为NA |
| C.摩尔、质量、时间、长度等是7个基本物理量之一 |
| D.22.4L氧气含有的分子数为NA |
NA表示阿伏加德罗常数,下列说法中正确的是
A.H2SO4的摩尔质量是98
B.1.7g NH3含有的电子数为NA
C.摩尔、质量、时间、长度等是7个基本物理量之一
D.22.4L氧气含有的分子数为NA
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)? △H=—92.4kJ/mol,
2NH3(g)? △H=—92.4kJ/mol,
其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
试判断K1??????? K2(填写“>” “ =”或“<”)。
(2)用2mol N2和3mol H2合成氨,三容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是???????? ,都达到平衡状态时,N2转化率最低的是??? 。
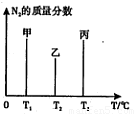
(3)NH3与CO2在120oC,催化剂作用下可以合成反应生成尿素:CO2 +2NH3  (NH2)2CO +H2O
(NH2)2CO +H2O
在密闭反应容器中,混合气体中NH3的含量变化关系如图所示

(该条件下尿素为固体)。则A点的正反应/速率 (CO2)?????? B点的逆反应速率
(CO2)?????? B点的逆反应速率 (CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____????????? ;
(CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____????????? ;
(4)已知下列热化学方程式:
2H2(g)+O2(g)=2H2O(1) ?? △H = -571.6kJ/mol
N2(g)+O2(g) 2NO(g)???? △H =+180kJ/mol
2NO(g)???? △H =+180kJ/mol
请写出用NH3还原NO的热化学方程式_????????????????? ;
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____????? 。科学家利用此原理,设计成氨气-氧气燃料电池,则通人氨气的电极是???????? (填“正极”或“负极”),在碱性条件下,通人氨气的电极发生的电极反应式为?????????????????????????????????? 。
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):
⑴装置Ⅰ中的主要离子方程式为 。3
⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
⑶写出装置Ⅱ中,酸性条件下的离子方程式 。
⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。②写出与阴极的反应式 。
⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示, 计算结果保留整数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com