
题目列表(包括答案和解析)
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为??????????????? 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为????????????????????????????? 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式?????????????????????????? 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K=??????? 。
Y2O3(g),其平衡常数表达式为K=??????? 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g)?? △H=+180 kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为???????????????????? 。
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
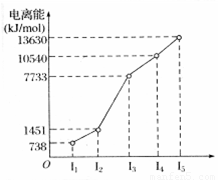
(1)X原子的电子排布式为 。
(2)电负性:X Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。 有关Z2H4分子的说法正确的是 (填字母)。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.Z原子的杂化方式为sp2
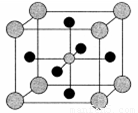
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构如图所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围 (填数字)个氧离子相紧邻。
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.非极性键 C.配位键 D.金属键
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
 Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com