
题目列表(包括答案和解析)
 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| ||
| ||
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A与足量的酸反应,测量生成CO2气体的质量。
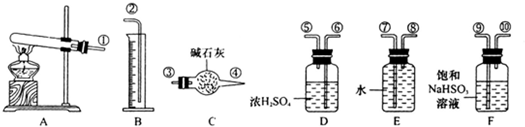
可供选择的仪器和药品如图所示:(酸溶液限选6mol/LHCl或6mol/LH2SO4,其它试剂任选。)
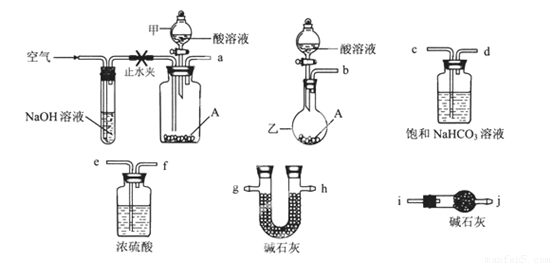
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2〜3次,将洗涤液过滤,洗涤沉淀2〜3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
A.科学性 B.安全性 C.可行性 D.简约性
(4)x与y的关系式是________ (用等式表示)。
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g. mol-1。实验II中称得样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________。
现有如下的实验用品:
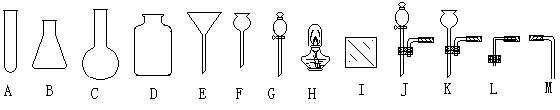
(I)玻璃仪器及其他仪器:试管、锥形瓶、园底烧瓶、集气瓶、长颈漏斗、球形漏斗、分液漏斗、酒精灯、白玻片、火柴、橡胶管及部分组合仪器(双、孔橡皮塞与玻管的组合)
(II)化学药品:双氧水、二氧化锰、木条
请选择上述仪器并设计制备氧气的最佳实验装置,且收集一瓶氧气。
回答以下问题:
① 从科学性、可行性、简约性、安全性角度分析,最佳实验装置中应该选择的仪器编号是____(每种仪器只能取用一次);
② 仪器装配的原则是____;
③ 你在装配过程中第一个所选择的玻璃仪器是___;
④ 仪器装配完成后的第一个实验操作是____。
⑤ 请设计一实验用于验证收集的气体是氧气,并叙述其检验过程。
(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
A.①多 B.②多 C.相等 D.无法判断
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完 全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com