
题目列表(包括答案和解析)
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为____________。
(2)工业上可通过如下流程由粗硅制取纯硅:
Si(粗)![]() SiCl4(l)
SiCl4(l) ![]() Si(纯)
Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8 t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:

反应①:Si(粗)+3HCl(g) ![]() SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2![]() Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
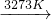 Si(粗)+2CO↑.
Si(粗)+2CO↑.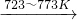 SiCl4(l);SiCl4+2H2
SiCl4(l);SiCl4+2H2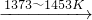 Si(纯)+4HCl
Si(纯)+4HCl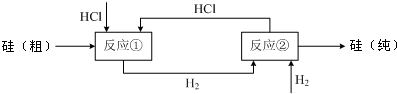
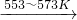 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)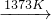 Si(纯)+3HCl
Si(纯)+3HCl工业生产硅(粗)的主要原理为:SiO2+2C![]() Si(粗)+2CO↑。
Si(粗)+2CO↑。
(1)在制硅(粗)的过程中同时会有碳化硅生成,若产物硅和碳化硅的物质的量之比为1:1,则参加反应的C 和SiO2的质量比为________________。
(2)工业上可通过以下步骤实现硅(粗)高度纯化:
Si(粗)+2Cl2(g)![]() SiCl4(l);SiCl4+2H2
SiCl4(l);SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC, 则生产25.2吨纯硅需纯度为75%石英砂多少吨?
(3)工业上还可以通过如下图所示的流程制取纯硅:

反应①:Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2![]() Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%。设损失的HCl、H2不能参与循环,则在下一轮次的生产中,需补充投入HCl和H2的物质的量之比是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com