
题目列表(包括答案和解析)
| 应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需的其它仪器 |
2.1 2.1 |
250 250 |
量筒、烧杯、玻璃棒、胶头滴管 量筒、烧杯、玻璃棒、胶头滴管 |
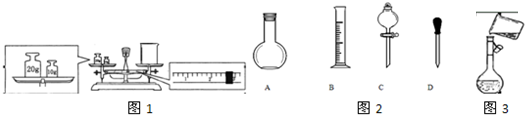
(12分)实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| | | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com