
题目列表(包括答案和解析)
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O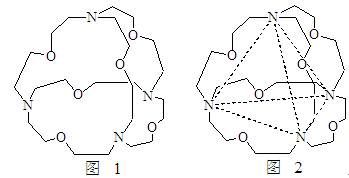
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
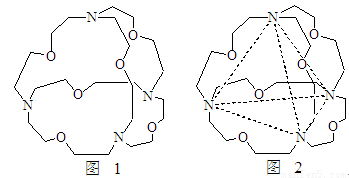
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
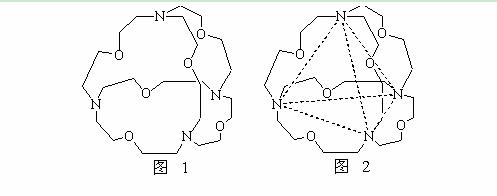
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O
H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O
(2013?德州二模)已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下不正确的是( )
| |||||||||||||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com