
题目列表(包括答案和解析)
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
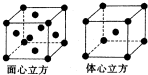
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是 周期 族。
(2)A与C形成的18电子分子的结构式为 。
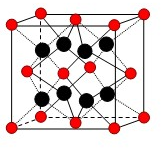
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |

| T/K | 303 | 313 | 323 |
| BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
(1)Al13代表的含义是____________。
A.铝是13号元素 B.铝原子有13个电子
C.铝原子有13个质子 D.由13个铝原子组成的新物质
(2)科学家预言“超级原子”的发现将会重建周期表,因为Al13、Al14的性质很像现行元素周期表中的某主族元素。已知当这类“超级原子”具有40个价电子时最稳定(铝原子具有3个价电子),类似于稀有气体的最外层8个电子的稳定性。
①铝在元素周期表中的位置:第______________周期第______________族,其原子结构示意图为______________。
②Al13有39个价电子,所以与______________(填主族)的元素性质类似;Al14有______________个价电子,且与______________的元素性质相似。
(3)这些“超级原子”的制备方法是:首先在实验室中将金属铝制成蒸气,在这个过程中会形成一些由多个铝原子组成的极其微小的球体,用质谱仪从铝蒸气中可以过滤出Al13“超级原子”,也就是说由13个铝原子组成的小球最稳定,这些“超级原子”能够与呈链形的碘分子发生化学反应,反应原理是Al13“超级原子”取代了碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在Al13“超级原子”上。
①关于“超级原子”Al13与碘反应的产物叙述错误的是______________。
A.是一种新的碘铝化合物
B.是碘与铝的混合物
C.该物质具有碘的性质
D.该物质具有铝的性质
②“超级原子”Al13在气相中还能与HI发生化合反应,请你写出这个反应的化学方程式_____________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com