
题目列表(包括答案和解析)
| 通电 |
| 加热 |
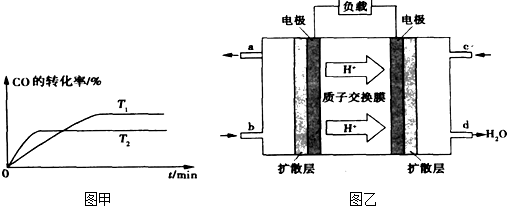
 H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: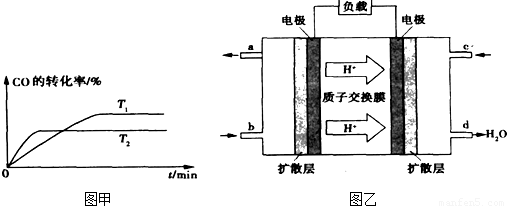
某实验小组对FeCl3的性质和用途展开了实验。
实验一:
实验步骤
①往锥形瓶中加入50 mL、3.0%的双氧水。
②分别往锥形瓶中加0.5 g不同的催化剂粉末,立即塞上橡皮塞。
③采集和记录数据。
④整理数据得出下表。
表:不同催化剂催化双氧水分解产生O2的压强对反应时间的斜率
| 催化剂 | 氯化铁 | 二氧化锰 | 猪肝 | 马铃薯 |
| 压强对时间的斜率 | 0.0605 | 3.8214 | 0.3981 | 0.0049 |
(1)该“实验一”的实验名称是 ;
(2)催化效果最好的催化剂是 ;
实验二:氯化铁催化分解双氧水的最佳条件
该实验小组的同学在进行实验二时,得到了如下的数据。
表:不同浓度的双氧水在不同用量的FeCl3?6H2O作用下完全反应所需时间
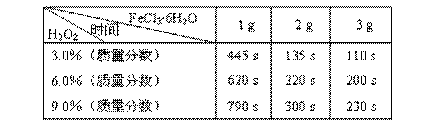
分析表中数据我们可以得出:
(3)如果从实验结果和节省药品的角度综合分析,当选用6.0%的双氧水时,加入______g FeCl3?6H2O能使实验效果最佳;
(4)进行该实验时,控制不变的因素有反应温度、 等;
(5)如图是2 gFeCl3?6H2O催化分解50 ml3.0%的双氧水时收集到的O2体积对反应时间示意图,请分别画出相同条件下1 g、3 g FeCl3?6H2O催化分解50 ml3.0%的双氧水时收集到的同温同压下O2体积对反应时间示意图,并作必要的标注;

讨论:有关FeCl3参加的可逆反应的两个问题:
(6)分别取若干毫升稀FeCl3溶液与稀KSCN
溶液混合,溶液呈血红色。限用FeCl3、KSCN、
KCl三种试剂,仪器不限,为证明FeCl3溶液与
KSCN溶液的反应是一个可逆反应,至少还要进行
次实验;
(7)一定浓度的FeCl3与KSCN两溶液反应达到平衡,在t1时刻加入一些FeCl3固体,反应重新达到平衡。若其反应过程可用如下的速率v―时间t图像表示。

请根据此图像和平衡移动规律求证新平衡下FeCl3的浓度比原平衡大
。
 H2+I2
H2+I2  CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: 

让人死里逃生的叠氮化钠
如果你驾着车撞到了路边的树上,你可能会对这些美丽的树木颇有微词。但当你从扭曲的汽车里狼狈地爬出来时,你却应该由衷地感谢一种名叫叠氮化钠的化合物,正是它救了你的性命。叠氮化钠看起来是一种非常危险的化学物质——它具有强烈的毒性和爆炸性——但它能在瞬间发挥作用,挽救你的生命。
现代汽车工业生产出来的汽车,是工程技术的伟大创举,生产时为在撞车事故中挽救车内人员生命所采取的安全性措施也不少,但人们还是会在事故发生时死于车内,危险最大的就是司机和坐在前排的乘客。根据美国国家公路交通安全管理局的调查,每年都约有两万名坐在汽车前排的人因事故丧生,约三万人受伤后需接受治疗。
挽救这些人生命的方法之一,就是把这种相当危险的化学物质叠氮化钠放入车中,只需250克(约合半磅)即可救人于危险之中。当汽车发生剧烈碰撞时,会触发这种化学物质产生爆炸,使气袋立即膨胀,气袋可以保持坐在车前排的乘员在发生撞击时,不致让头部和颈部撞在钢架、仪表盘或挡风玻璃上。据统计,在美国,这种气袋已挽救了一千二百多名乘客的生命。
生产商在20世纪50年代就为气袋申请了专利。当时的设计是使气体从一个压缩气罐里释放出来,填充气袋。由于压缩气罐不可预料的特性和气罐内压力变化的原因,这种做法很不可靠,所以难以流行。解决之道就是用叠氮化钠来取代压缩气罐,通过在碰撞时使叠氮化钠“爆炸”来产生大量气体。一定数量的叠氮化钠可以在极短的时间内放出一定数量的氮气,这有利于整个过程的控制。
使气袋充气的过程如下:假设你正在驾驶着一辆汽车,撞到了另一辆车或某个固定物体,如果撞击速度高于每小时10英里(约合16千米),就会记录在电子控制器的传感器内,由电子控制器决定是否打开气袋。此控制器可能位于汽车的前部,或者靠近司机放脚的地方,或者可以和气袋放在一起。控制器会分析汽车产生的负加速度,以区分出产生的碰撞是来自于撞车或撞墙之类有生命危险的事故,还是仅仅由于颠簸造成的。如果是前者,它将发动起爆器(也叫爆筒),接下来就点燃叠氮化钠。叠氮化钠的爆炸产生大量气体,这些气体充入尼龙气袋时会受到过滤。当司机和前排乘客向前冲时,气袋可以起到缓冲作用,从而使他们免受致命的伤害。控制器分析撞击并能使气袋膨胀在0.025秒之内完成,这比一眨眼的速度还快四倍。千分之几秒后,司机和前排乘客会撞在气袋上,然后气袋会立即收缩,热的氮气能在可控方式下从两旁泄掉。
能使气袋正常发挥作用的混合化学物质就是所谓的爆炸剂,其中包括叠氮化钠、硝酸钾和二氧化硅。这一系列化学反应是从电子打火装置点燃叠氮化钠(化学式是NaN3)开始的。这能使局部温度上升到300 ℃,足以使大部分爆炸物迅速分解。首先,叠氮化钠燃烧产生出熔化的金属钠和氮气的混合物。然后,金属钠和硝酸钾反应释放出更多的氮气并形成氧化钾和氧化钠。这些氧化物会立即与二氧化硅结合,形成无害的硅酸钠玻璃。然后经过过滤,只有氮气充进了气袋。
人们对气袋普遍有一种畏惧心理。其一,人们害怕爆炸物发生爆炸时产生的巨响会把他们震聋;其二,人们害怕会被撞得失去知觉,导致脸埋在气袋里产生窒息。需要说明的是,事实上,这些担心都是不必要的:大多数遭遇撞车的人都注意不到气袋张开时产生的声响,因为碰撞本身产生的轰响会淹没气袋的声音;另外,人也不会产生窒息,因为设计人员在设计气袋时就已考虑到了这一点,在乘员扑到气袋上一秒钟之后,气袋就会完全收缩。
思考:写出NaN3发生爆炸充气的一系列化学反应方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com