
题目列表(包括答案和解析)
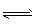 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。 
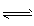 CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题:
CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题: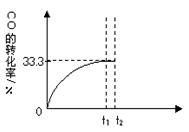
 2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:若定义某物质的转化率为消耗掉的该物质的物质的量占起始时该物质的原物质的量的百分比。已知合成氨反应为N2(g) + 3H2(g) ![]() 2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
(1)氮气的转化率
(2)用氢气表示平均反应速率是多少?
(3)平衡状态时氢气的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com