
题目列表(包括答案和解析)
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 1mol/L的CuSO4溶液 1mol/L的CuSO4溶液 删除此空 删除此空 |
若 溶液中出现黑色沉淀 溶液中出现黑色沉淀 ,则假设1 1 成立. |
| 步骤:2:另取少许反应后溶液于试管中,滴加 1-2滴淀粉KI溶液 1-2滴淀粉KI溶液 |
若 溶液变蓝 溶液变蓝 ,则假设2 2 成立.若 步骤1中没有出现黑色沉淀,步骤2中溶液不变蓝色 步骤1中没有出现黑色沉淀,步骤2中溶液不变蓝色 ,则假设3成立. |
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … |
若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计实验方案.验证假设]:该小组对燃烧后的白色产物进行如下探究:
|
实验 方案 |
实验操作 |
实验现象 |
结论 |
|
方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
|
方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
|
③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显 现象 |
[思考与交流]
(1)甲同学认为方案1得到的结论不正确,其理由是 。
(2)乙同学认为方案2得到的结论正确,白色物质为 。
(3)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。由此得出钠在二氧化碳中燃烧的化学方程式为 。
(4)丙同学认为白色物质有可能是氢氧化钠。你______(是.否)同意丙同学的观点,并简述理由: 。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
写出银氨溶液与乙醛反应生成银镜的化学方程式:
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO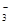 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①测定上述实验用的Fe(NO3)3溶液的pH值 ②配制 溶液,并将适量此溶液加入 内。 …… | 若 ,假设2成立。 若 ,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO![]() 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com