
题目列表(包括答案和解析)
| A、①③⑤ | B、②④⑤ | C、③④ | D、④⑤ |
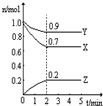
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
 2Z
2Z 2Z
2ZA.4 B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com