
题目列表(包括答案和解析)
已知:4NH3+5O2 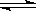 4NO+6H2O,若反应速率分别用
4NO+6H2O,若反应速率分别用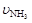 、
、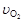 、
、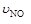 、
、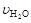 [(mol
/ (L·min)]表示,则正确的关系是
( )
[(mol
/ (L·min)]表示,则正确的关系是
( )
A. 4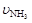 =5
=5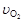 B. 5
B. 5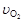 =6
=6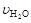 C. 4
C. 4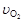 =5
=5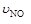 D. 2
D. 2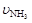 =3
=3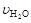
已知:4NH3+5O2 4NO+6H2O,若反应速率分别用
4NO+6H2O,若反应速率分别用 、
、 、
、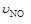 、
、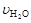 [(mol / (L·min)]表示,则正确的关系是 ( )
[(mol / (L·min)]表示,则正确的关系是 ( )
A.4 =5 =5 | B.5 =6 =6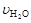 | C.2 =3 =3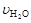 | D.4 =5 =5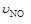 |
下列热化学方程式正确的是(注:ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
(2011·湖北省八校联考)25℃时,pH=13的氨水中由水电离出的c(H+)=a,pH=1的盐酸中由水电离出的c(H+)=b,0.2 mol·L-1盐酸与0.1 mol·L-1氢氧化钠溶液等体积混合后,由水电离出的c(H+)=c,则a、b、c的关系正确的是( )
A.a>b=c B.a=b=c
C.c>a=b D.a>c>b
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA |
NaOH |
混合溶液的pH |
|
甲 |
[HA]=0.2 mol·L-1 |
[NaOH]=0.2 mol·L-1 |
pH=a |
|
乙 |
[HA]=c1 mol·L-1 |
[NaOH]=0.2 mol·L-1 |
pH=7 |
|
丙 |
[HA]=0.1 mol·L-1 |
[NaOH]=0.1 mol·L-1 |
pH=9 |
|
丁 |
pH=2 |
pH=12 |
pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?
(2)c1 (填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是 (从下面选项中选择填空)
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ,其中,[A-]= mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA] (填“<”、“>”或“=”)[NaOH], b 7(填“<”、“>”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com