
题目列表(包括答案和解析)
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
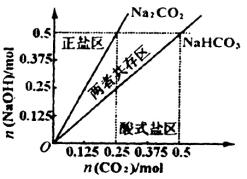
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() 且n(
且n(![]() )=)0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=)0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
用NaOH(s)、水、大理石和盐酸制取33 g纯NaHCO3。
请参照物质的溶解度表回答下列问题:
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
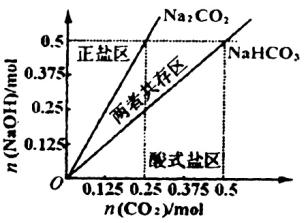
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() ,且n(
,且n(![]() )=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
请参照物质的溶解度表回答下列问题:
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
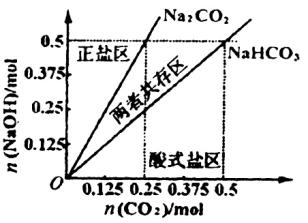
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() ,且n(
,且n(![]() )=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.| 53(w-m) |
| 22n |
| 53(w-m) |
| 22n |

现要用结晶法从A、B混合物中提取A(不考虑A、B共存时对A、B溶解度的影响)。
(1)取50 g混合物,将它们溶于100 g热水,然后冷却至20 ℃。若要A析出而B不析出,则B的质量分数最高不能超过多少?
(2)取W g混合物,将它们溶于100 g热水,然后冷却至10 ℃。若要使A析出而B不析出,请写出下列两种情况下,混合物A的质量分数w(A)应当满足什么关系式。
①当W<a+b时,w(A) 。
②当W>a+b时,w(A) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com