
题目列表(包括答案和解析)
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |



 、
、 、
、
 、
、 、
、

2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
下图表示物质A~H的转化关系,其中D为非金属固体单质,其余的为化合物。①为工业生产中常见反应,且F必须密封保存,否则遇潮湿空气即产生含碳质量分数最高的常见气态烃。经测定固体G由三种元素组成,其中钙元素占50.00%、碳占15.00%(元素质量分数)。H是能使湿润的红色石蕊试纸变蓝的气体。
![]()
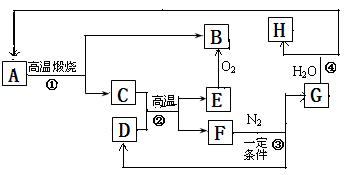
![]() ⑴F的电子式为
⑴F的电子式为
![]() (2)写出③化学反应方程式
(2)写出③化学反应方程式
![]() 写出④化学反应方程式
写出④化学反应方程式
![]() (3)B和H在一定的条件下反应可得到一种有机肥料甲。甲在一定条件下分解得到B、H和三聚氰胺(C3H6N6),请写出该反应方程式
(3)B和H在一定的条件下反应可得到一种有机肥料甲。甲在一定条件下分解得到B、H和三聚氰胺(C3H6N6),请写出该反应方程式
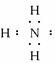
请按要求回答:
(1)写出A的化学式______________,H的电子式______________。
(2)反应⑤进行的条件是______________________________。
(3)将少量的D气体通入足量的NaOH溶液的离子反应方程式为______________________________。
(4)反应③的化学方程式为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com