
题目列表(包括答案和解析)
(10分)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+) =0.056 mol•L-1,那么需调节溶液的pH = ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)=1: 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)
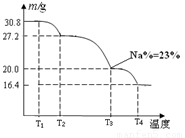
(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。 [来源:ZXXK]
(10分)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:

(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+) =0.056 mol•L-1,那么需调节溶液的pH = ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)=1:1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)
(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。
(10分)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下: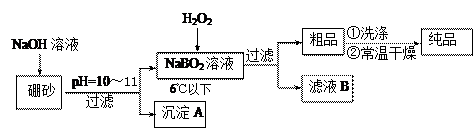
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+)=0.056 mol?L-1,那么需调节溶液的pH= ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)="1:" 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)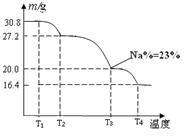
(4)若反应温度控制不当,所得的过硼酸钠晶 体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。[来源:学科网ZXXK]
体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。[来源:学科网ZXXK]
| |||||
已知 25℃ 时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列说法正确的是 ( )
A.等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa)
B.浓度均为0.2mol/LNaHCO3和 Na2CO3溶液中,存在的粒子种类不相同
C.0.4 mol·L-1HCN 溶液与 0.2 mol·L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+)
D.25℃ 时,pH=4且浓度均为0.1 mol·L-1的 CH3COOH、CH3COONa混合溶液中:
c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com