
题目列表(包括答案和解析)
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH<7,向该溶液中加入氢氧化钠溶液,Kw增大
B.pH=8的NaOH溶液稀释100倍,其pH=6
C.将1L 0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12
D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
有一包固体混合物,可能含有的阴、阳离子分别是:
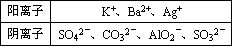
为了鉴定其中的离子,现进行如下实验.根据实验现象,填写下表:
(1)取该粉末,加水后得到无色溶液,用pH试纸测得溶液的pH=12.

(2)向溶液中滴加盐酸,先有沉淀生成,继续滴加沉淀消失,同时有无色无味气体逸出.

(3)尚待检验的离子及其检验方法

有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg([H+]/[OH-]).
请回答下列问题:
(1)在25℃时,若溶液呈中性,则AG=________.
(2)在25℃时,若溶液的pH=12,则AG=________.
(3)在25℃时,溶液的pH与AG的换算公式为AG=________(要化简).
(4)在25℃时,将AG=-12的NaOH溶液a L与AG=12的H2SO4溶液b L混合,若所得混合液的AG=10,则a∶b=________.
常温下,将0.02 mol·L-1的Ba(OH)2溶液100mL和0.02 mol·L-1NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液
A.pH=12 B.pH=2
C.由水电离的产生的c(H+)=1.0×10-12 mol·L-1 D.溶质的物质的量浓度=0.02 mol·L-1
|
现有常温下的四份溶液: ①0.01 mol/L CH3COOH ②0.01 mol/L HCl ③pH=12的氨水 ④pH=12的NaOH溶液下列说法正确的是 | |
A. |
①中水电离程度最小,③中水电离程度最大 |
B. |
将②③混合,若pH=7,则消耗溶液的体积:②>③ |
C. |
将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
D. |
将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com