
题目列表(包括答案和解析)
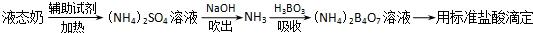
| 编号 | 样品和辅助试剂 | 消耗盐酸体积 |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45mL |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55mL |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50mL |
| 4 | 10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸 | 1.50mL |
 Mn(OH)2+
Mn(OH)2+ O2--H2MnO3
O2--H2MnO3 MnMnO3+
MnMnO3+ H2SO4+
H2SO4+ KI---
KI--- MnSO4+
MnSO4+ I2+
I2+ H2O+
H2O+ K2SO4
K2SO4维生素C又称抗坏血酸,广泛存在于水果、蔬菜中,属于外源性维生素,人体不能自身合成,必须从食物中摄取。其化学式为C6H8O6,相对分子量为176.1,由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,半反应为:
C6H8O6=C6H6O6+2H++2e j y =0.18V
因此,可以采用碘量法测定维生素C药片中抗坏血酸的含量。具体实验步骤及结果如下:
(1)准确移取0.01667mol/L的K2Cr2O7标准溶液10.00mL于碘量瓶中,加3mol/L H2SO4溶液10mL,10% KI溶液10mL,塞上瓶塞,暗处放置反应5min,加入100mL水稀释,用Na2S2O3标准溶液滴定至淡黄色时,加入2mL淀粉溶液,继续滴定至溶液由蓝色变为亮绿色。平行三次实验,消耗Na2S2O3标准溶液平均体积为19.76mL。
(2)准确移取上述Na2S2O3标准溶液10.00mL于锥瓶中,加水50mL,淀粉溶液2mL,用I2标准溶液滴定至蓝色且30s不褪。平行三次实验,消耗I2标准溶液平均体积为10.15mL。
(3)准确称取0.2205g的维生素C粉末(维生素C药片研细所得)于锥瓶中,加新煮沸过并冷却的蒸馏水100mL,2 mol/L HAc溶液10mL,淀粉溶液2mL,立即用I2标准溶液滴定至蓝色且30s不褪,消耗12.50mL。
(4)重复操作步骤(3),称取维生素C粉末0.2176g,消耗I2标准溶液为12.36mL;称取维生素C粉末0.2332g,消耗I2标准溶液为13.21mL。
根据以上实验结果计算出该维生素C药片中所含抗坏血酸的质量分数。
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1))重晶石(BaS04)常作胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时, 溶液中 c(Ba2+)= 。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]常作分析剂。
①检验晶体中含有NH4+的方法为_______。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中C(NH4+)由大到小的顺序为 (填选项字母)。
(3)过二硫酸钾(K2S2O8)常作强氧化剂,Na2S2O3常作还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色, 该反应的离子方程式为
②用铂作电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_____ __电解过程中阴极附近溶液的pH将______ (填“增大”、“减小”或“不变”)
③产品中K2S2O8的含量可用碘量法测定。操作步骤为:称取0.3g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以______为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00mL。该产品中K2S2O8的质量分数为(杂质不参加反应) (列式并计算)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com