
题目列表(包括答案和解析)
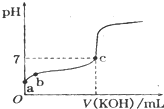 已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.
已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.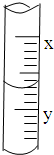 如图是 10ml 量筒的一部分,数字XY之间相差 1ml,若 X=5,则量筒所盛液体的体积是( )
如图是 10ml 量筒的一部分,数字XY之间相差 1ml,若 X=5,则量筒所盛液体的体积是( )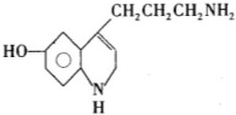 ( )
( )| A、性质稳步定难氧化 | B、使紫色石蕊试液变红 | C、能发生加成反应 | D、遇FeCl3溶液变红色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com