
题目列表(包括答案和解析)
| |||||
在一个体积为2 L的密闭容器中,高温下发生下列反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g)+Q kJ
FeO(s)+CO(g)+Q kJ
其中CO2、CO的物质的量(mol)随时间(min)的变化如图所示.
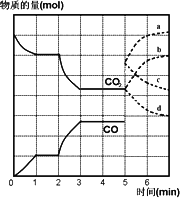
1.反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g.用CO的浓度变化表示的反应速率v(CO)=________.
2.反应进行至2 min时,若只改变一个条件,曲线发生的变化如图所示,3 min时再次达到平衡,则Q________0(填“>”、“<”或“=”).第一次平衡与第二次平衡的平衡常数相比,K1________K2.(填“>”、“<”或“=”).
3.5 min时再充入一定量的CO(g),平衡发生移动.下列说法正确的是________(填写编号).
a.v(正)先增大后减小
b.v(正)先减小后增大
c.v(逆)先增大后减小
d.v(逆)先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号).
4.请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:________.
已知:4NH3+5O2 4NO+6H2O,若反应速率分别用
4NO+6H2O,若反应速率分别用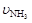 、
、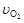 、
、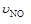 、
、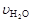 [(mol / (L·min)]表示,则正确的关系是 ( )
[(mol / (L·min)]表示,则正确的关系是 ( )
A.4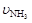 =5 =5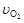 | B.5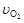 =6 =6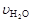 | C.4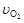 =5 =5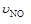 | D.2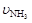 =3 =3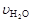 |
1mol某有机物完全燃烧生成2mol CO2和2mol H2O,则此有机物除可能是CH3CHO外还可能是烯烃结构简式_________、酯的结构简式________、羧酸的结构简式_______。
1.HCOOCH3 2.CH2=CH2 3.CH2=CHCH3 4.CH3COOH 5.HCOOC2H5 6.CH3COOC2H5
在温度为830K时,可逆反应CO+H2O![]() H2+CO2,其平衡具有某些特殊性,若起始浓度CO为2mol·L-1,H2O为3mol·L-1,反应达到平衡时,CO转化率为60%;如果将H2O的起始浓度加大到6mol·L-1,则CO转化率为75%.注意上述有关数据,总结出其中规律,填写以下空白:设830K时起始浓度CO为a mol·L-1,H2O为b mol·L-1,反应达到平衡时,H2浓度为c mol·L-1.
H2+CO2,其平衡具有某些特殊性,若起始浓度CO为2mol·L-1,H2O为3mol·L-1,反应达到平衡时,CO转化率为60%;如果将H2O的起始浓度加大到6mol·L-1,则CO转化率为75%.注意上述有关数据,总结出其中规律,填写以下空白:设830K时起始浓度CO为a mol·L-1,H2O为b mol·L-1,反应达到平衡时,H2浓度为c mol·L-1.
(1)当b不变,a变小,达到平衡时,CO的转化率________,H2O的转化率________(填“升高”、“降低”或“不变”).
(2)当a=5,c=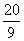 时,b=________.
时,b=________.
(3)a=b时,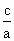 =________.
=________.
(4)a,b,c间关系可表示为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com