
题目列表(包括答案和解析)
(8分)当Cu2+溶液中杂有少量Fe3+时,常用调节pH的方法来使Fe3+沉淀完全。因为当Fe3+沉淀完全时Cu2+还没有开始沉淀。有同学为探究当Mg2+溶液中杂有少量Fe3+时,是否也可用上述方法进行除杂,特查阅有关数据如下:常温时,Ksp[Mg(OH)2]=4×10-12,Ksp[Fe(OH)3]=8.0×10-38;通常认为某离子残留在溶液中的浓度小于1×10-5 mol?L-1时就认为该离子已经沉淀完全。
假定原溶液中c(Mg2+)=1mol?L-1,c(Fe3+)=0.01mol?L-1。
(1)使Fe3+开始沉淀时溶液中pH约为 ;
(2)当Fe3+沉淀完全时溶液中c(OH-)约为 mol/l;此时,Mg2+ (填写编号:A:尚未开始沉淀;B:已经开始沉淀;C:已经沉淀完全);
(3)结论:在杂有少量Fe3+的Mg2+溶液中, (填编号:A:可以;B:不可以)用调节pH的方法来除杂。
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。已知25℃时,以下五种物质的K s p:
|
| AgCl | Ag2CrO4 | AgBr | AgI | Ag2S |
| K s p | 2×10-10 | 2×10-12 | 5.4×10-13 | 8.3×10-17 | 6.3 ×10-50 |
| 颜色 | 白色 | 砖红色 | 淡黄色 | 黄色 | 黑色 |
现以0.1mol/L的AgNO3溶液测定某溶液中c(Cl-),适宜做该滴定指示剂的物质是
A.K2CrO4 B.KBr C.KI D.K2S
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为 ;
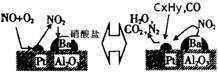
(2)除氮氧化物及CO外,汽车尾气中 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy ,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g) 2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠
2H2(g)+O2(g) 2H2O(g) K2=2×1081 ㈡
2H2O(g) K2=2×1081 ㈡
2CO2 (g) 2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
+O2(g) 平衡常数K= ;
②关于以上反应,下列说法正确的是
A. 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 |
| B.若升高温度,反应㈢的平衡常数K3将增大 |
| C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大 |
| D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放 |
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为 ;
(2)除氮氧化物及CO外,汽车尾气中还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧化物是NO2,碳氢化合物是CxHy,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g) 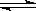 2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠
2H2(g)+O2(g) 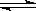 2H2O(g)
K2=2×1081 ㈡
2H2O(g)
K2=2×1081 ㈡
2CO2 (g) 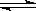 2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢
 ①常温下,反应2H2O(g)
2H2(g) +O2(g) 平衡常数K= ;
①常温下,反应2H2O(g)
2H2(g) +O2(g) 平衡常数K= ;
②关于以上反应,下列说法正确的是
A.常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2
B.若升高温度,反应㈢的平衡常数K3将增大
C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大
D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放
③基于环保法规,要求改装汽车尾气处理装置,达到使氮氧化物(NO)、一氧化碳转化为无污染、可排放的气体的目的。改装的方法主要是加入有效催化剂,请你根据以上有关数据分析,在不改变其它条件的情况下,可使用催化剂除污染气体的原因: 。
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在同一条件下,下列反应的平衡常数的数值如下:
2NO(g)  N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)  2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)  2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
在同一条件下,以下说法正确的是( )
A. NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.水分解产生O2,此时平衡常数的数值约为5×10-80
C.NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com