
题目列表(包括答案和解析)
已知在酸性条件下有以下反应:①2BrO3-+I2===2IO3-+Br2;②2IO3-+10Br-+12H+===I2+5Br2+6H2O。
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,你认为是否正确?______________________________
(若认为正确则填“正确”,若认为不正确则填“不正确”并说明理由)。
(2)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图所示关系:
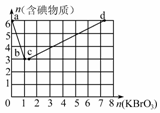
①a→b阶段的反应中氧化剂与还原剂的物质的量之比为________。b点时,KI全部参与反应,则b点处对应的含碘物质的化学式为________。
②b→c阶段的反应中有一种元素的价态发生了变化,此阶段反应的离子方程式为________。
③n(KBrO3)=4时,对应含碘物质的化学式为________。
④含a mol KI的硫酸溶液所能消耗KBrO3物质的量的最大值为________。
已知在酸性条件下有如下关系:①KBrO3能把KI氧化成I2或KIO3,KBrO3本身被还原为Br2;②Br2能氧化I-为I2③KIO3能氧化I-为I2;④KIO3能氧化Br-为 Br2。在③④反应中KlO3被还原为I2。试回答:
(1)KBrO3、KIO3、Br2、I2氧化性由弱到强的顺序。
(2)现取6mL0.4mo1·L-1KBrO3溶液和10mL0.4mo1·L-1KI溶液在稀H2SO4中混合,
生成的产物是什么?物质的量之比为多少?
(1)KBrO3、KIO3、Br2、I2氧化性由弱到强的顺序。
(2)现取6mL0.4mo1·L-1KBrO3溶液和10mL0.4mo1·L-1KI溶液在稀H2SO4中混合,
生成的产物是什么?物质的量之比为多少?
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:
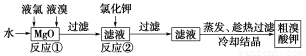
根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为_____________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+=5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+=5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+=3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com