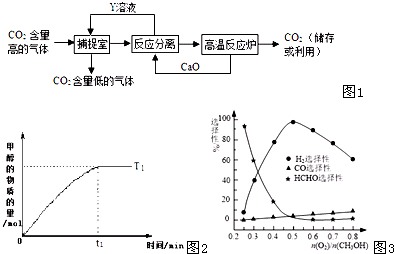
二氧化碳捕集、存储和转化是当今化学研究的热点问题之一,科学家一般利用NaOH溶液或氨水喷淋“捕捉”空气中的CO
2,用NaOH溶液“捕捉”空气中的CO
2的流程如图1所示.

(1)下列有关该捕捉过程的叙述正确的有______
A.捕捉到的CO
2可制备其它化工产品,减少了温室气体排放
B.“反应分离室”中的反应要吸收大量热
C.整个过程中,只有一种物质可循环利用
D.能耗大是该捕捉技术的一大缺点
(2)一定条件光催化分解CO
2发生反应:2CO
2(g)2CO(g)+O
2(g),该反应的△S______0、△H______0(填“>”、“<”、“=”)
(3)以CO
2与H
2为原料还可合成液体燃料甲醇(CH
3OH),其反应的化学方程为:CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g)△H<0.
①将1mol CO
2和3mol H
2充入2L的密闭容器中发生上述反应,下列说法正确的是______.
A.若保持恒温,则达到平衡时反应速率3V
正(H
2)=V
逆(CH
3OH)
B.若为绝热容器,当容器内混合气体的温度恒定时,该反应已达平衡状态
C.从反应开始至达到平衡的过程中,CO和H
2的转化率均相等
D.保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO
2和3mol H
2,当达到新平衡时,n(CH
3OH):n(H
2)将升高
②若其他条件不变,在恒容、温度T
1时甲醇的物质的量与时间的图象如图2所示.请补充完成温度为T
2(化学平衡常数K(T
1)>K(T
2))时甲醇的物质的量随时间变化的示意图.
③在一个有催化剂的固定容积的容器中加入1mol CO
2,3mol H
2,在一定温度下充分反应达到平衡,放出热量为a kJ.若在原来的容器中只加入1mol CH
3OH(g)和1mol H
2O(g),在相同温度下充分反应,达到平衡时吸收热量为b kJ.则反应CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g) 的△H=______kJ?mol
-1 (用含a、b的代数式表示).
(4)在一定温度下以Ag/CeO
2-ZnO为催化剂时甲醇与氧气的比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图3所示.则当n(O
2)/n(CH
3OH)=0.25时,CH
3OH与O
2发生的主要反应方程式为______




![]() (g) +3H2(g)
(g) +3H2(g) ![]() 2NH3(g)反应,在t1时缩小容器
2NH3(g)反应,在t1时缩小容器

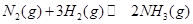 反应,在t1时缩小容器
反应,在t1时缩小容器