
题目列表(包括答案和解析)
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池。氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(I)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。写出其正极电极反应式 。
(II)以上述电池为电源,石墨为电极电解1L 0. 1mol/L的氯化钾溶液。回答下列问题:
(1)写出电解总反应的离子方程式 。
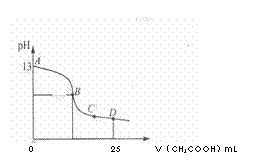
(2)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①计算消耗标准状况下甲烷 mL。
②若图中的B点pH=7,则酸碱恰好完全反应的点在 区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系中可能正确的是 。
A. c(K+)>c(OH-)>c (CH3COO-) >c(H+)
B. c(K+)>c(CH3COO-)>c(OH-) >c(H+)
C. c(K+)>c(CH3COO-)=c(OH-) >c(H+)
下列叙述不正确的是:
A.用反应热数据的大小判断不同反应反应速率的快慢
B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.用平衡常数的大小判断化学反应可能进行的程度
| A.用反应热数据的大小判断不同反应反应速率的快慢 |
| B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.用平衡常数的大小判断化学反应可能进行的程度 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com