
题目列表(包括答案和解析)
过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4 +2H2SO4![]() 2Na2SO4+O2↑+2H2O+2CO2↑
2Na2SO4+O2↑+2H2O+2CO2↑
某过碳酸钠样品中含有少量Na2O2,甲、乙两位同学各称质量为mg的该样品,选用下图所示的仪器组合成测定样品的纯度的装置。仪器的连接顺序,甲是①⑦③⑥④;乙是①②。
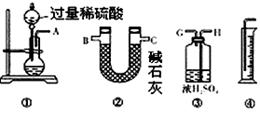
(1)甲同学想通过实验测得的数据是 。他连接装置的顺序存在错误,调整的方法是 。
(2)乙同学想通过实验测得的数据是 。按他测得的数据计算出来的实验结果 (填“偏高”、“偏低”或“无影响”),理由是 。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进,写出各接口的连接顺序: 。
(4)按你改进的实验装置进行实验,若测得实验前后装置②的质量分别是W1g和W2g,则样品中过碳酸钠的质量分数为 。
| ||
| △ |
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
A A |
分液漏斗:浓氨水 锥形瓶:过氧化钠(或Na2O2) 分液漏斗:浓氨水 锥形瓶:过氧化钠(或Na2O2) |
提供反应物 提供反应物 |
D D |
碱石灰 碱石灰 |
干燥混合气体 干燥混合气体 |
B B |
铂粉 铂粉 |
反应的催化剂 反应的催化剂 |
C(D) C(D) |
氢氧化钠溶液(碱石灰) 氢氧化钠溶液(碱石灰) |
吸收氮的氧化物,防止污染空气 吸收氮的氧化物,防止污染空气 |
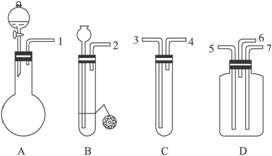
图4-6
可选用的仪器:(上图仪器可重复使用)
可选用的试剂:①盐酸 ②溴水 ③Na2SO3固体 ④FeS固体 ⑤品红溶液 ⑥氢氧化钠溶液
试完成以下问题:
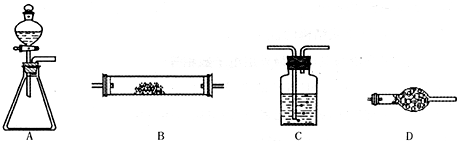
(1)按SO2(足量)气流方向,用胶管(未画出)连接上述仪器组合成整套装置,正确的连接顺序是(用数字1,2,…填入):( )→( )( )→( )(6)→( )。
(2)下述A—C装置中,应加入的试剂(从①②③④⑤⑥中选取)是:A、___________B、___________C___________。
(3)表现SO2氧化性的实验是上述仪器中的___________装置(填仪器装置代号A、B、C、D),实验过程中能观察到的实验现象是___________;表现SO2还原性的实验是上述仪器中的装置___________(填仪器装置代号A、B、C、D),实验过程中能观察到的实验现象是___________。
(4)为了防止污染空气,在装置D的出气管口应___________。
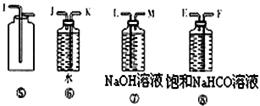
(12分) 为了进行氨的催化氧化实验:4NH3+5O2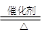 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
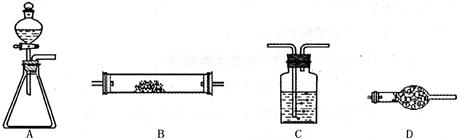
将所选的仪器按连接顺序由上至下依次填入下表(可不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h
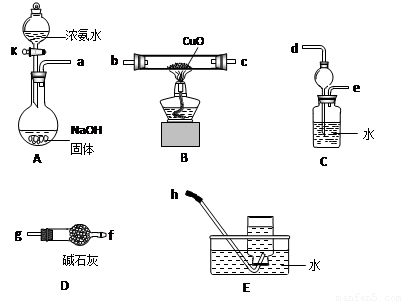
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com