
题目列表(包括答案和解析)
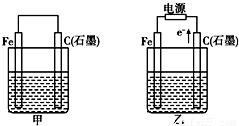
 如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )
如图甲、乙是电化学实验装置.有关电极反应或计算错误的是( )如图甲、乙是电化学实验装置。有关电极反应或计算错误的是:
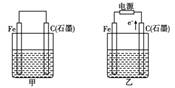
A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-= 4OH-
B.若乙烧杯中盛有则乙中的总反应为
C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-= Fe2+
D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6 g CuO
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑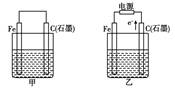
常温下,下列关于溶液pH的计算错误的是
A.pH等于1的HNO3与pH等于13的Ba(OH)2溶液等体积混合后,溶液pH为7
B.pH等于3的盐酸稀释105倍后,溶液pH接近于7
C.0.01mol/L的CH3COOH溶液pH大于2漂白性
D.pH等于10和pH等于12的两种NaOH溶液等体积混合后,溶液中的c(H+)等于![]() mol/L
mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com