
题目列表(包括答案和解析)
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。
已知:A(s)+B(g)===C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
(1)写出A元素的名称________。
(2)另外知:
A(s)+O2(g)===G(g) ΔH=-393.6 kJ·mol-1
C(g)+![]() O2(g)===G(g) ΔH=-283 kJ·mol-1
O2(g)===G(g) ΔH=-283 kJ·mol-1
D(g)+![]() O2(g)===B(g) ΔH=-242 kJ·mol-1
O2(g)===B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由_____________________________________________________________________ 。
(3)写出A + O2 = C的热化学方程式: 。

A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。
已知:A(s)+B(g)===C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
(1)写出A元素的名称________。
(2)另外知:
A(s)+O2(g)===G(g) ΔH=-393.6 kJ·mol-1
C(g)+![]() O2(g)===G(g) ΔH=-283 kJ·mol-1
O2(g)===G(g) ΔH=-283 kJ·mol-1
D(g)+![]() O2(g)===B(g) ΔH=-242 kJ·mol-1
O2(g)===B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由_______________________________________________。
(3)写出A + O2 = C的热化学方程式: 。


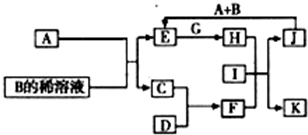 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com