
题目列表(包括答案和解析)
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
《物质结构与性质》(选做题)
29.C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A 强 B 弱 C 相等 D 无法判断
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为![]()
![]()
![]()
![]()
![]()

![]()
![]()

(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ;
 ③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2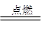 2MgO;②3Mg+N2
2MgO;②3Mg+N2 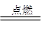 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2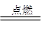 2MgO+C
2MgO+C
④Mg+H2O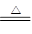 MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
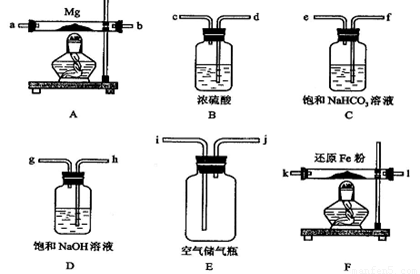
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为_______________________ _________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________ ;
(3)通气后,应先点燃 处的酒精灯,再点燃 处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?________ __,
原因是__ __ __;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:
______________________________________________________________________
(5)已知Mg3N2是离子化合物,请写出其电子式 ;
证明Mg3N2是离子化合物实验依据是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com