
题目列表(包括答案和解析)
 化合物b中进行sp
化合物b中进行sp 3杂化的原子有:
3杂化的原子有: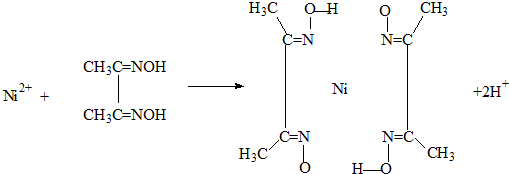
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.| 表1温度 | 表2氢气压力 | 表3催化剂用量 | 表4吗啉用量 | |||||||||||||||
| 序号 | 温度/℃ | 转化率/% | 选择 性/% |
反应时间/h | 序号 | 氢气压力/MPa | 选择性/% | 反应时间/h | 序号 | 雷尼镍用量/g | 选择性/% | 反应时间/h | 序号 | 吗啉用量/% | 选择性/% | |||
| ① | 40 | 未完全 | 99.6 | 6 | ① | 0.5 | 99.6 | 3.7 | ① | 2 | 98.25 | 5 | ① | 0.0 | 84.3 | |||
| ② | 60 | 100 | 99.7 | 4 | ② | 1.0 | 99.7 | 2 | ② | 4 | 99.20 | 2.2 | ② | 0.3 | 99.3 | |||
| ③ | 80 | 100 | 99.6 | 2.45 | ③ | 1.5 | 99.2 | 1.6 | ③ | 6 | 99.60 | 1.9 | ③ | 0.5 | 99.7 | |||
| ④ | 100 | 100 | 99.6 | 2 | ④ | 2.0 | 96.4 | 1.15 | ④ | 8 | 99.60 | 1.4 | ④ | 0.7 | 99.6 | |||
| ⑤ | 120 | 100 | 98.6 | 1.7 | ⑤ | ⑤ | 10 | 99.10 | 1.4 | ⑤ | 1.2 | 99.7 | ||||||
(A)【物质结构与性质】
有A、B、C、D、E、F六种元素,B原子得到一个电子后3p轨道全充满,A+比B原子形成的离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。
请回答下列问题:
(1)A元素位于元素周期表中第_________周期第_________族;F元素基态原子形成的+2价阳离子的电子排布式为_________。
(2)C与B形成的CB3分子中C原子的杂化方式是_______,其分子的空间形状是_______。
(3)另一元素X与A同主族,其第一电离能小于A,晶体XB与AB熔点较高的是_________,其理由是_______________________________________________________________。
(4)1 mol ED晶体中含有的E—D共价键的数目是_________。
(B)【实验化学】
阿司匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:

在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL 饱和碳酸氢钠溶液,加完后继续搅拌2—3 min,直到没有二氧化碳气体产生为止。过滤,用5—10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4 mol·L-1盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1—2次,再抽干水分,即得产品。
请回答下列问题:
(1)第①步中,要控制温度在85—
(2)在第②步中,用冷水洗涤晶体,其目的是_________________________________________、__________________________________________。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是___________________________________,加入盐酸的作用是________________________________________。
(4)如何检验产品中是否混有水杨酸?___________________________________________
____________________________________________________________________。
(A)【物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

(1)T3+的核外电子排布式是____________。
(2)Q、R、M的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是______________________(填序号)。
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线形分子,不存在配位键。写出其结构式:_________________。
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是____________(填G或R的元素符号)。

(B)【实验化学】
某资料显示,能使双氧水分解的催化剂有很多种,生物催化剂(如猪肝)、离子型催化剂(如FeCl3)和固体催化剂(如MnO2)等都是较好的催化剂。某实验小组通过测定双氧水分解产生的O2的压强,探究分解过氧化氢的最佳催化剂以及探究最佳催化剂合适的催化条件。
(一)探究一:
实验步骤
(1)往锥形瓶中加入50 mL 1.5%的双氧水
(2)分别往锥形瓶中加
(3)采集和记录数据。
(4)整理数据得出下表
不同催化剂“压强对时间斜率”的比较
催化剂 | 猪肝 | 马铃薯 | 氯化铜 | 氯化铁 | 氧化铜 | 二氧化锰 |
压强对时间的斜率 | 0.191 87 | 0.002 42 | 0.007 93 | 0.030 5 | 0.015 47 | 1.833 6 |
①该“探究一”实验的名称是_____________________________________________________。
②该实验所得出的结论是_______________________________________________________。
(二)探究二:二氧化锰催化的最佳催化条件
该实验小组的同学在进行探究二的实验时,得到了一系列的图表和数据。参看下图和表格分别回答相关问题。

3%的双氧水与不同用量二氧化锰的压力—时间图
表:不同浓度的双氧水在不同用量的二氧化锰作用下收集相同状况下同体积O2所需时间
MnO2 时间 H2O2 | |||
1.5% | 223 s | 67 s | 56 s |
3.0% | 308 s | 109 s | 98 s |
4.5% | 395 s | 149 s | 116 s |
分析图、表中数据我们可以得出:
③同浓度的双氧水的分解速率随着二氧化锰用量的增加而_________________,因而反应时间_______________。
④如果从实验结果和节省药品的角度综合分析,你认为当我们选用3.0%的双氧水,加入___________ g的二氧化锰能使实验效果最佳。你判断的理由是______________________。
⑤该小组的某同学通过分析数据得出了当催化剂用量相同时双氧水的浓度越小反应速率越快的结论,你认为是否正确____________,你的理由是________________________________。
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。

③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:

环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com