
题目列表(包括答案和解析)
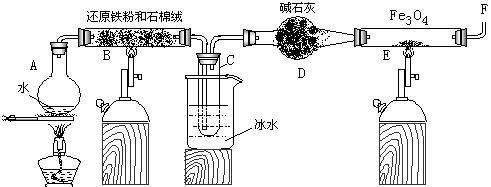
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
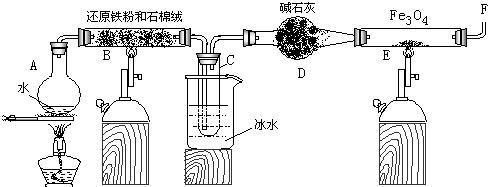
(1) 烧瓶A中常加入碎瓷片,其作用是 ,
小试管C的作用是 。
(2) 为了安全,在E管中的反应发生前,在F出口处必须 ,
E管中的反应开始后, 在F出口处应 。
(3) 反应3Fe +4H2O(g) ![]() Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
。
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中
含有Fe3+的实验操作及现象
。
| |||||||||||||||||||
 Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释 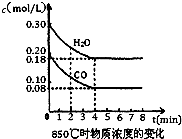 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.| 1 | 2 |
| 1 |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com