
题目列表(包括答案和解析)
| 由多项式的乘法法则知:若(x+a)(x+b)=x2+x+q,则p=a+b,q=a·b;反过来x2+x+q=(x+a)(x+b)要将多项式x2+x+q进行分解,关键是找到两个数a、b,使a+b=p,a·b=q,如对多项式x2-3x+2,有p=-3,q=2,a=-1,b=-2。此时(-1)+(-2)=-3,(-1)(-2)=2,所以x2-3x+2可分解为(x-1)(x-2)即x2-3x-2=(x-1)(x-2)。 (1)根据以上填写下表: | ||||||||||||||||||||||||||||||
当q是正数时,应分解成两个因数a、b_______________号,a、b的符号与__________相同; 当q是负数时,应分解成的两个因数a、b______________号,a、b中绝对值较大的因数的符号与_______相同。 (3)分解因式: x2-x-12=_____________;x2-7x+6=________________。 |
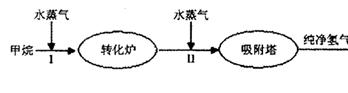
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
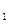 达到平衡、在时刻t
达到平衡、在时刻t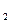 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t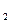 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)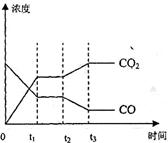
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
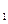 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t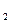 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)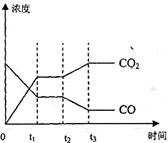
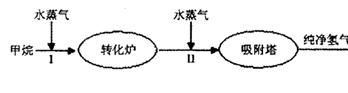
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
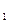 达到平衡、在时刻t
达到平衡、在时刻t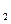 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t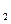 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)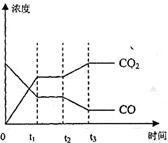
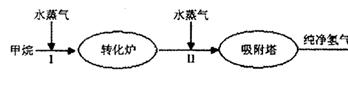
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
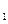 达到平衡、在时刻t
达到平衡、在时刻t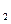 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t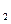 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)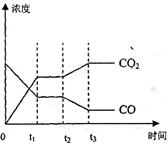
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com