
题目列表(包括答案和解析)
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氯化剂 |
| 氯化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |

| H2SO4 |
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氯化剂 |
| 氯化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |
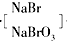
| H2SO4 |



 Br2(g)
Br2(g)
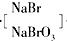
 Br2
Br2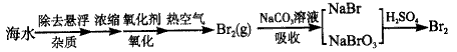
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示。同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究。
(1)同学们首先排除了试剂的成分是硫酸铜、硫酸铁、硫酸亚铁等的可能,理由是 _______ ___。
(2)取出少量溶液置于试管中,向其中滴入石蕊试液,石蕊试液呈现红色,同学们认为可以排除硫酸钠、硫酸钾等,理由是_______ _______________;但是不能排除是硫酸铵的可能性,其原因是(用离子方程式表示)____ ____。
(3)另取出少量溶液置于试管中,向其中加入锌粒,有大量无色气泡快速冒出。根据此现象,可推测溶质可能是下列物质中的__________________(填字母代号),生成气体的有关反应的离子方程式为_________ _________________________ 。
A.NaHSO4 B.(NH4)2SO4 C.MgSO4 D.H2SO4 E.Al2 (SO4)3

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com