(2011?西安模拟)[化学一选修物质结构与性质]
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是
由于HF中含有氢键相结合的聚合氟化氢分子(HF)n
由于HF中含有氢键相结合的聚合氟化氢分子(HF)n
.
(3)C、D、E可组成离子化合物D
xE
6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D
+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC
6x-(用

示)位于该正方体的顶点和面心,该化合物的化学式是
Na3AlF6
Na3AlF6
.

(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
|
Mn |
Fe |
电离
能/kJ?mol-1 |
Ⅰ1 |
717 |
759 |
| Ⅱ2 |
1509 |
1561 |
| Ⅲ3 |
3248 |
2957 |
回答下列问题:
Mn元素价电子层的电子排布式为
3d54s2
3d54s2
,比较两元素的I
2J
3可知,气态Mn
2+再失去一个电子比气态Fe
2+再失去一个电子难.对此的解释是
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
具有弧对电子
具有弧对电子
.
②六氰合亚铁离子(Fe(CN)
64-)中的配体CN
-中c原子的杂化轨遣类型是
sp
sp
;
写出一种与CN
-互为等电子体的单质分子的路易斯结构式
N≡N
N≡N
.


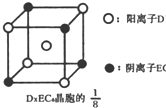
 示)位于该正方体的顶点和面心,该化合物的化学式是______.
示)位于该正方体的顶点和面心,该化合物的化学式是______.
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是