A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC
2,FC
3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA
5,其电子式为
.
(5)将0.4mol FC
2和0.2mol C
2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC
2+C
2?2FC
3,当FC
2百分含量不变时,得到0.2mol FC
3气体,则此时反应的平衡常数K=
.
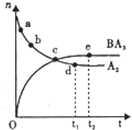
(6)向一绝热恒容密闭容器中通入B
2和A
2,在一定条件下发生反应B
2(g)+3A
2(g)?2BA
3(g)△H<0,达到平衡,n(A
2)和n(BA
3)随时间变化的关系如图所示.下列有关叙述一定正确的是
.
A.c点表示BA
3生成速率与BA
3分解速率相等
B.c点和e点 A
2的转化率相等
C.平衡后再升高温度,不利于BA
3的合成
D.d点时:n(A
2):n(BA
3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
(用必要的化学用语和适当的文字说明).

 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白: