
题目列表(包括答案和解析)
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |

 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数。
(1)已知:H2NCOONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(H2NCOO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(H2NCOO-)随时间变化趋势如图所示。
![]()
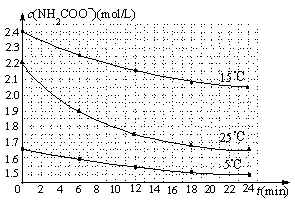
①25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
②对比图中哪两条曲线,能得出“水解反应速率随温度升高而增大”的结论? 。
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
③能标志该分解反应已经达到化学平衡状态的是 。
A.单位时间内生成1 mol CO2的同时消耗2 mol NH3
B.容器内气体压强保持不变
C.容器中CO2与NH3的物质的量之比保持不变
D.容器中混合气体的密度保持不变
④根据表中数据计算,15.0℃时的分解平衡常数(Kc)为 。
⑤氨基甲酸铵分解反应属于 反应(填放热或吸热),理由是 。
⑥氨基甲酸铵分解反应的熵变△S 0(填>、<或=)。
(10分)
以天然气为原料经由合成气(CO 、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(1)甲烷的部分氧化。其反应式如下:
 CH4(g) + 1/2O2 (g)=CO (g) + 2H2(g);ΔH =-35.6 kJ·mol-1。
CH4(g) + 1/2O2 (g)=CO (g) + 2H2(g);ΔH =-35.6 kJ·mol-1。
则该反应的ΔS ▲ 0(填“>”、“<”或“=”)。
有研究认为甲烷部分氧化的机理为:
① CH4(g) + 2O2 (g) =CO 2(g) + 2H2O(g);ΔH1=-890.3 kJ·mol-1
② CH4(g) + CO2 (g) = 2CO (g) + 2H2(g);ΔH2=247.3 kJ·mol-1
③ CH4(g) + H2O (g) = CO (g) + 3H2(g);ΔH3= ▲ kJ·mol-1
(2)甲烷水蒸汽催化重整。如右上图所示热氦气从下部流入提供能量。由甲烷和水蒸汽混合气从催化管的上部流入,从下端出来后再向上进入中心管。根据下表数据计算甲烷的转化率为 ▲ 。
| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g·s―1 | 出口流量/ g·s―1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
(3)甲烷二氧化碳催化重整。高温下,该反应速率明显降低的原因可能是 ▲ 。
(4)甲烷的部分氧化与重整耦合。以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气。下列说法错误的是 ▲ (填序号)。
A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.发电尾气的出口温度较高,可以利用以节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.因发电尾气反应中包含甲烷燃烧,可实现部分热量自供,可降低成本
(12分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)  ?2NH3(g)+CO2(g)
?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压 强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体 总浓度/ mol·L-1 |
2.4× 10-3 |
3.4× 10-3 |
4.8× 10-3 |
6.8× 10-3 |
9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是( )
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)该分解反应的平衡常数表达式为____________________________,根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________________。(保留两位有效数字)
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”“减少”或“不变”);
(4)氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS________0 (填“>”“=”或“<”)。此反应在该温度下能自发进行原因是 ________ 效应大于 ___________效应.
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O | B.稀KOH溶液、异丙醇 | C.NH4Cl溶液、异丙醇 | D.Fe(NO3)3溶液、异丙醇 |
 CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH- Cr2O72-+H2O
Cr2O72-+H2O 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com