
题目列表(包括答案和解析)
水是地球上最重要的一种物质,试回答下列问题:
Ⅰ.饮用水的安全事关人民的健康,在饮用水的处理过程中,经常要用到消毒剂,其中以“84”消毒液、漂白粉等较为常见。除了上述消毒剂以外,ClO2由于处理水时不产生致癌的有机氯化物,因此已经逐渐地取代氯气等成为饮用水处理中常用的消毒剂。
(1)漂白粉的商品名又叫漂白精,其中包装袋上注明保存时要密封,启用后需要立即使用,切忌长时间放置,请用化学方程式表示其原因:______________________________________。
(2)生产ClO2常用的方法是在酸性条件下还原NaClO3,例如:
①2ClO![]() +4H++2Cl-===2ClO2↑+Cl2↑+2H2O
+4H++2Cl-===2ClO2↑+Cl2↑+2H2O
②2ClO![]() +SO
+SO![]() +2H+===2ClO2↑+SO
+2H+===2ClO2↑+SO![]() +H2O
+H2O
比较两种方法,你认为__________比较好,优点是________________________________________________。
Ⅱ.海水中含有大量的宝贵资源,工业上从海洋中制溴的方法是:先把盐卤(海水中氯化钠被分离后剩下的母液)加热到363 K后控制pH为3.5,通入氧气把溴置换出来,再用一种气体X把溴吹出并用碳酸钠溶液吸收,这时溴就歧化生成溴离子和溴酸根离子,最后用硫酸酸化,单质溴就从溶液中析出。根据上述信息回答下列问题:
(1)把溴吹出的气体X,工业上最适宜选用________。
A.NH3 B.空气 C.氩气 D.CO2
(2)用Na2CO3溶液吸收溴,再用硫酸酸化,析出溴,是工业上获取溴的方法之一。用离子方程式表示该反应过程:
①____________________________________;
②____________________________________。
 2NH3(g)
2NH3(g)| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
 [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+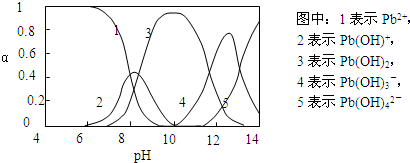
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
![]() (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
![]() (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
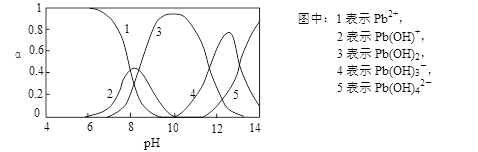
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
 (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)
2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)
2NH3(g)
其化学平衡常数K与温度t的关系如下表:
|
t/K |
298 |
398 |
498 |
… |
|
K/(mol·L-1)2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。[来源:Z_xx_k.Com]
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
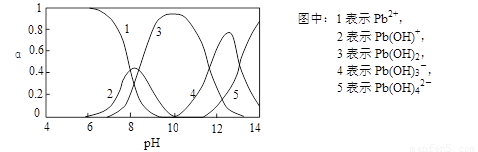 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com