
题目列表(包括答案和解析)
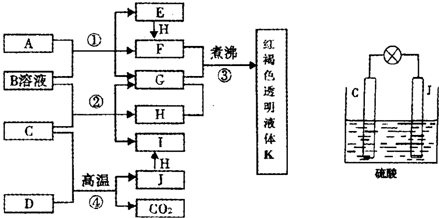

完成下列问题:?
(1)A的晶体类型为: ,J在常温下是 色的气体。?
(2)写出H、K的化学式,H ,K 。?
(3)完成化学反应方程式:?
A+B→C+D: 。?
(4)写出下列反应的离子方程式:?
C+E→H2+混合物: ;?
G+氨水→K+L: 。
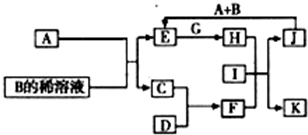 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.A~L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去)。已知A为金属单质,C、D通常状况下为气体单质。B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L。G和I分别由相同的两种元素组成,通常状况下均为无色液体。
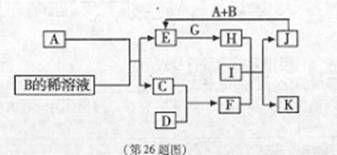
(1)B的化学式为 ;工业上冶炼金属A的方法称为 。
(2)向E的溶液中加入氢氧化钠溶液的实验现象为 ,反应的化学方程式为 。
(3)写出E的酸性溶液与G反应转化为H的离子方程式 。
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明) 。
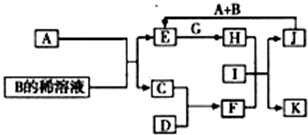 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com