如图是工业生产硝酸铵的流程.
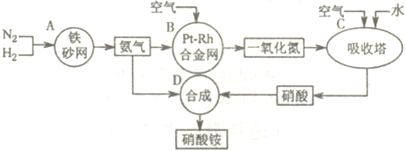
(1)A、B、C、D四个容器中的反应,属于氧化还原反应的是
(填字母).
(2)已知:
4NH
3(g)+3O
2(g)═2N
2(g)+6H
2O(g)△H=一1266.8kJ/mol
N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
,
氨催化氧化反应的化学平衡常数表达式K=
.
(3)已知:N
2(g)+3H
2(g)?2NH
3(g)△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有
.(填字母)
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气 E.及时移出氨
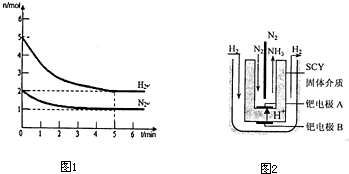
(4)在一定温度和压强下,将H
2和N
2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH
3的气体体积分数为17.6%,此时H
2的转化率为
.