
题目列表(包括答案和解析)
| ||
| 熔融 |
| ||
| 熔融 |
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 。
|
④在NaNO2 溶液中,质子守恒表达式为
___________________________________________。
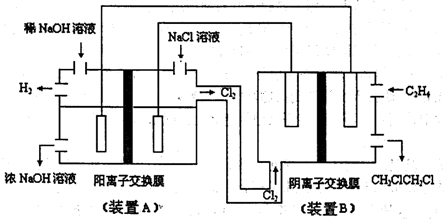
(2)电化学降解NO3—的原理如右图所示。
| |
阴极反应式为:
。
 A、B、C、D、E五种物质(或离子)均含有同一种短周期元素,它们之间有如转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种短周期元素,它们之间有如转化关系:| 1 |
| 2 |
| 1 |
| 2 |
(1)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜,其工作原理如图所示。
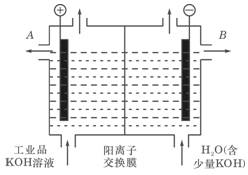
①该电解槽的阳极反应式是: 。
②除去杂质后的氢氧化钾溶液从液体出口____(填写“A”或“B”)导出。
(2)如图,有一综合电解装置,A、B、C均为0.1L 1mol/L溶液,通电一段时间后,B池溶液质量增加6.3 g,试回答:
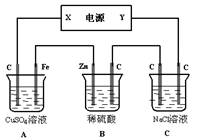
①C 池阳极放出气体在标准状况下的体积为 L ;
②A 池要恢复溶液组成,可加入 mol ;
③若电源为铅蓄电池,电极材料分别为铅和二氧化铅,以硫酸作电解质溶液,则Y极电极反应式为 ,X极质量 (填“增大”或“减小”) g。
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-![]() H++A2-,写出下列物质的水溶液的相应关系式:
H++A2-,写出下列物质的水溶液的相应关系式:
(1)NaHA溶液中的离子浓度大小关系:________
(2)NaHA溶液的物料守恒式:________
(3)溶液的电荷守恒式:________
(4)NaHA溶液的质子守恒式:________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com