(2011?信阳二模)在下列物质转化关系中,反应的条件和部分产物已略去.
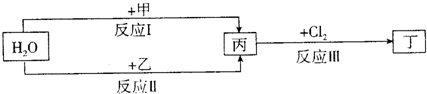
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是
C
C
.
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H
2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是
.
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性
强
强
(填“强”或“弱”),比较二者金属性强弱的依据还可以是
NaOH是强碱,Fe(OH)3是弱碱
NaOH是强碱,Fe(OH)3是弱碱
(写出一种即可).
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应.
①反应Ⅲ的化学方程式是
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.
②反应I的另一种产物为有机物,则该有机物的电子式是
.
③反应Ⅱ是化合反应.乙可与硫酸铵共热反应制氨气,则此反应的化学方程式是
CaO+(NH4)2SO4=CaSO4+2NH3↑+H2O
CaO+(NH4)2SO4=CaSO4+2NH3↑+H2O
.
④在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体.其反应的离子方程式是
2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑
2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑
.



