
题目列表(包括答案和解析)
|
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是 | |
| [ ] | |
A. |
将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 |
B. |
在相同条件下等质量的大理石块和大理石粉与相同浓度的盐酸反应时,粉比块反应快 |
C. |
将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 |
D. |
两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加点二氧化锰,同时加热,放出氧气的快慢不同 |
| 实验 序号 |
铝的 质量/g |
铝的 形态 |
c(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铝片 | 0.8 | 50 | 20 | 35 | 200 |
| 2 | 0.10 | 铝粉 | 0.8 | 50 | 20 | 36 | 25 |
| 3 | 0.10 | 铝片 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 铝片 | 1.0 | 50 | 35 | 50 | 50 |
Ⅰ.下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积2mol/L的硫酸于试管中 ② |
Mg产生气泡速率快于Fe,Cu无明显变化 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是探究 。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。
(13分)
Ⅰ.(3分)下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.(10分)影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积2mol/L的硫酸于试管中 ② |
反应速率Mg>Fe,Cu反应最慢 |
金属性质越活泼,反应 速率越快 |
(1)甲同学表中实验步骤②为 ;
(2) 甲同学的实验目的是 ;要得出正确的实验结论,还需要控制的实验条件是 。
乙同学为了更精确地研究浓度对反应速率的影响,利用右图所示装置进行定量实验。
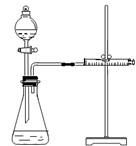
(3)乙同学在实验中应该测定的数据是 ;
(4)乙同学完成实验应选用的实验药品是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com