
题目列表(包括答案和解析)
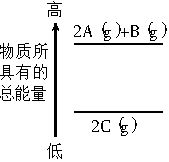
分析如右图所示的能量变化示意图,下列热化学方程式正确的是 ( )。
A.2A(g)+B(g)=2C(g)
ΔH=a(a>0)
B.2A(g)+B(g)=2C(g) ΔH=a(a<0)
C.2A+B=2C ΔH=a(a<0)
D.2C=2A+B ΔH=a(a>0)
为了探究铜与浓硫酸的反应,某研究性学习小组做了如下实验:
①在放有铜片的圆底烧瓶中加入10 mL浓硫酸,加热煮沸10 min(如上图所示)后,所得固体分离除去未反应的铜片,再经水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5 mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现浑浊。
④取少量不溶物,向其中加入3 mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。
为了解释上述现象,学习小组通过查阅资料了解到:
| a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质; b.CuS和Cu2S都能溶于热的浓盐酸; c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+, [Cu(NH3)2]+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。 |
回答下列问题:
(1)第②步操作要注意的问题是____________ ;对比①②两步操作中的现象,你能得到的结论是____________ 。
(2)第③步操作中出现的沉淀是____________ ,请解释出现这一现象的原因____________ 。
(3)写出④步涉及的离子方程式____________ 。
(4)综合分析铜与浓硫酸的反应,生成的不溶物是____________。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图是N2和H2反应生成2 mol NH3过程中能量变化示意图,写出生成NH3的热化学方程式:________________________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化
学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过
程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知反应N2(g)+3H2(g)  2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。
试根据表中所列键能数据估算a的数值:________。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |

 2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com